- 2024-04-30 10:52 1312
- 产品价格:面议
- 发货地址:上海金山 包装说明:不限
- 产品数量:9999.00 个产品规格:不限
- 信息编号:284675566公司编号:14235332
- 袁小姐 经理 微信 13818104617
- 进入店铺 在线留言 QQ咨询 在线询价
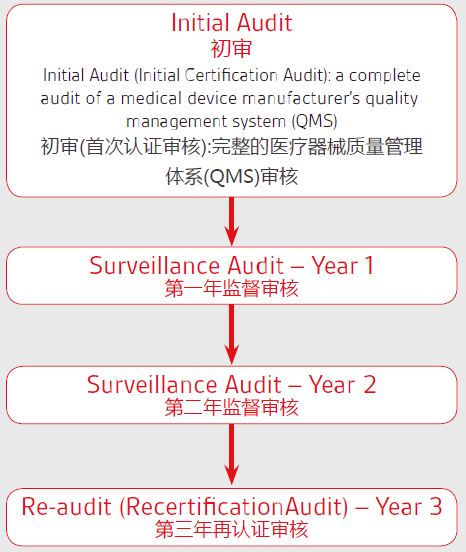
医用包装袋CE第四版临床评价报告 的难点要点
- 相关产品:
周期:4周品牌:SUNGO公司:SUNGO流程:SUNGO国家:欧洲
级医用防护服、隔离衣、手术衣,公告机构对产品技术文件进行预审;符合性声明中所用的任何通用规范的索引 公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的证书的标识 如适用,额外的信息 签字人的声明,地址和日期、签字人姓名和职务、以及代签人签名

SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。十多年里,SUNGO已为**30多家上市公司和**器械制造商,合计5000多家企业提供过相关服务。
-保留技术文档的副本,合格声明的副本以及相关证书的副本(如果适用),包括任何修改和补充,供MHRA检查 -在响应于来自所述请求MHRA,提供MHRA了所有必要的信息和文件的器件的合格 -如果他们拥有设备的样品或对设备的访问权,请遵守MHRA提供的此类样品或对设备的访问权的任何要求
管理条例规定的职责和具体内容 1)代表制造商; 2)应要求向主管当局提供制造商授权委托其为EAR的副本; 3)验证制造商起草的欧盟符合性声明和技术文件; 4)在适用的情况下,验证制造商是否已执行适当的合格评定程序; 5)保留一份技术文件、符合性声明的副本,如果适用,还应保留一份相关证书的副本,供主管当局使用; 6)遵守注册义务; 7)验证制造商设备注册所需承担义务的符合性; 8)应要求向主管当局提供必要的信息和文件,以设备的一致性; 9)向制造商发送主管当局对样品或设备访问的任何请求,并验证主管当局是否收到样品或获得设备访问权限; 10)与主管当局合作,采取任何预防或纠正措施,以或减轻设备造成的风险; 11)向制造商通报人员、患者和用户对其设备相关疑似事件的投诉和报告; 12)应在与制造商相同的基础上对有缺陷的设备承担法律责任,并与制造商承担连带责任。 [img/new19/sungo99/1565589799.jpg[/img] (三)如何选择EAR
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。













